EU-Bevollmächtigter
EU-Bevollmächtigter

Hintergrundkenntnisse
Um die Verbraucher und die Umwelt in der EU besser zu schützen und die Rückverfolgbarkeit von Medizinprodukten zu gewährleisten, fordert der Europäische Gesetzgeber den Herstellern auf, gültige CE-Kennzeichnung und Beschriftung mit ihren Namen und Anschriften auf dem Produkt anbringen, welches sie auf den Markt in der EU bringen möchten; Für die Hersteller mit Sitz außerhalb des Europäischen Wirtschaftsraums (einschließlich EU und EFTA), muss sein Produkt gleichzeitig die Namen und die Anschriften von dem Hersteller und dem EU-Bevollmächtigten (European Authorised Representative; EAR) tragen.Zur Verbesserung der Überwachungseffizienz fordert die Europäische Kommission alle Mitgliedstaaten auf, die niedrigen gesetzlichen Anforderungen zu erfüllen. Die EU-Kommission arbeitet mit dem Zoll, dem relevanten Herstellern, EU-Bevollmächtigten und Importeuren, zusammen, um ein vollständiges System zur Rückverfolgbarkeit von Produkten einzurichten.
Definition von EU-Bevollmächtigten
Der EU-Bevollmächtigte ist ein Unternehmen. Hat ein Hersteller, der in eigenem Namen ein Produkt in Verkehr bringt und keinen Sitz im Europäischen Wirtschaftsraum (einschließlich EU und EFTA), muss er nach der derzeit gültigen Fassung ein Unternehmen als einzigen Bevollmächtigten in dem Europäischen Wirtschaftsraum ausdrücklich benennen. Dieses Unternehmen kann im Namen des nicht in der EU ansässigen Herstellers handeln und dessen Aufgaben und bestimmten Pflichten nach der relevanten EU Richtlinie und Gesetze erfüllen. Die neue Richtlinie schreibt vor, dass der EU-Bevollmächtigte in dem Europäischen Wirtschaftsraum ansässig sein und eine handelsübliche Anschrift haben muss (einigen Ländern fordern noch die Handelsregisternummer oder EU Umsatzsteuer-Identifikationsnummer von dem Bevollmächtigten).Die Regierungen und zuständigen Behörden der EWR-Mitgliedsstaaten können jederzeit bei dem EU-Bevollmächtigen überprüfen, ob der nicht in der EU ansässige Hersteller die geforderten Aufgaben und Pflichten tatsächlich erfüllt haben. Der allgemeine Handelsvertreter (z.B. autorisierter Händler) des Herstellers, unabhängig davon, ob er seinen Sitz im Europäischen Wirtschaftsraum hat oder nicht, sollte nicht mit dem von der neuen Richtlinie angeforderten EU-Bevollmächtigen verwechselt werden. Wenngleich der EU-Bevollmächtigte im Namen des nicht in EU ansässigen Herstellers die von den relevanten EU Richtlinien und Gesetzen geforderte Aufgaben und Pflichten erfüllen kann, bleibt der Hersteller weiterhin beim Übernehmen von Hauptverantwortung.Ohne Zustimmung des Herstellers darf der EU-Bevollmächtigte die von dem nicht in EU ansässigen Hersteller hergestellte Produkte nicht modifizieren, auch wenn beim vorschriftswidrigen Produkten um die Anforderungen der EU-Produktrichtlinie beim zu erfüllen.
Der EU-Bevollmächtigte soll folgende Unterlagen aufbewahren
1. Konformitätserklärung,
2.Duplikate von Etiketten, Verpackungen und Gebrauchsanweisungen (in allen erforderlichen Sprachen von den Ländern, in den die Produkte auf den Markt gebracht sind),
3.(relevante) Zertifikate und Nachweise von der benannten Stelle,
4.Überwachungsprozesse und -daten nach dem Inverkehrbringen, Vigilanzberichte und Beschwerden, Prozesse und Daten.,
5.relevante technische Dokumente der von den Mitgliedstaaten durchgeführten Marktüberwachung,
6.relevante klinische Daten /Bekanntgaben,
7.Detaillierte Angaben zu alle Vertreiber/Lieferanten, die das Produkt auf den Markt bringen.,
8.Vorkommnisberichte sowie die ergriffene Maßnahmen
Die Pflichten der EU-Bevollmächtigten umfassen:
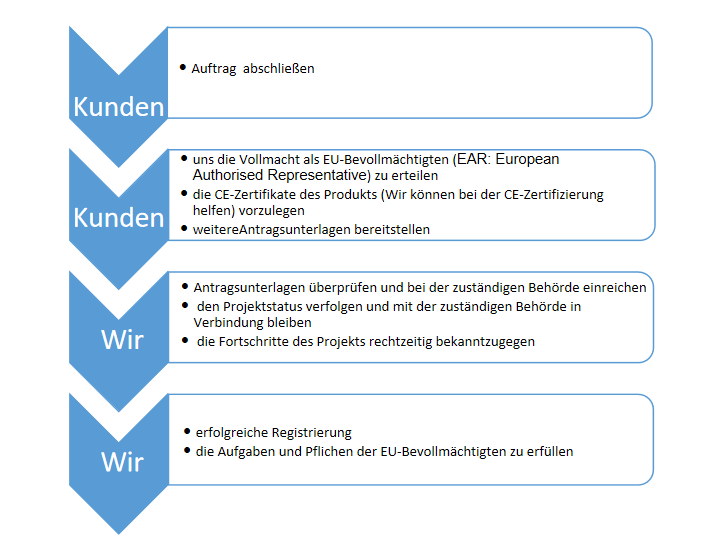
a) als authorized Representative des Herstellers, die Kontaktaufnahme mit den zuständigen Überwachungsbehörden in den Mitgliedstaaten zu nehmen, die Vorkommnisse, Beschwerden, unerwünschter Ereignisse und die Rückrufe von Medizinprodukten zu behandeln.
b) die technische Unterlagen des Herstellers zu aufbewahren, mit dem Hersteller in Verbindung zu setzen, die von den Überwachungsbehörden gestellte Fragen zu beantworten;
c) im Auftrag von dem Hersteller, die Registrierung für die Medizinprodukte in der Europäischen Union durchzuführen;
d) im Auftrag von dem Hersteller, Vertriebslizenz in der Europäischen Union zu beantragen。
Wir bieten Ihnen die Dienstleistungen wie Vertretung (European Authorised Representative EAR, EC Rep) und damit verbundene Zertifizierung an. Wir wünschen Ihnen viel Erfolg in Europa!
Download
Kontakt
Tri Rad Medical GmbH
 Tiergartenstraße 32
Tiergartenstraße 32
 01219 Dresden Germany
01219 Dresden Germany
 +49 (0) 351 – 2086 4877
+49 (0) 351 – 2086 4877
 +49 (0) 351 – 8627 8683
+49 (0) 351 – 8627 8683